在生物体内,生物大分子的氧化是一个由自由基介导的必要的生理过程。但是过量的自由基则会给细胞带来伤害甚至死亡,导致癌症、中风、糖尿病及心肌梗塞等疾病的发生。已有研究表明,食物来源的生物活性肽具有在体内清除自由基的能力,并且比合成的抗氧化剂更安全.目前,对食物蛋白质来源的酶水解物的抗氧化性研究主要集中在大豆蛋白、小麦蛋白、鹿茸和鱼等,而对核桃蛋白水解物抗氧化性的研究报道则较少.本文以碱性蛋白酶(Alcalase2.4L)水解核桃蛋白,对获得的水解产物进行了葡聚糖凝胶柱和反相层析分离纯化,测定了水解物对DPPH和羟自由基的清除能力,探讨了核桃蛋白水解物的抗氧化活性;对抗氧化能力强的多肽采用LC.ESI—Q—TOF鉴定了其一级序列。
1实验部分
1.1材料、试剂与仪器
核桃购自长春沃尔玛超市;碱性蛋白酶Alcalase2.4L购自丹麦Novozymes公司;HPLC级乙腈购自美国Fisher公司;1,1-diphenyl-2一picrylhydrazyl(DPPH),L-glutathionereduced(GSH)购自Sigma公司。
WatersAlliance2695高效液相色谱系统;Waters2996二极管阵列检测器;RRLC—Q—TOF6520质谱仪(Agilent公司);ZORBAXExtend—C18色谱柱(1.8um,2.1mmxl50mm,Agilent公司);多功能酶标仪(Tecan公司)。
1.2核桃蛋白酶解物的制备与分离纯化
1.2.1核桃蛋白的制备将核桃去皮粉碎过40目筛,用石油醚脱脂2次(料液体积比1:10);用NaOH调节pH=9.0,于45℃孵育lh,以3500r/min转速离心30min,取上清液调节pH=4.5后静置,以3500rmin转速离心30min,将沉淀用水洗至中性,冻干即得核桃蛋白。
1.2.2核桃蛋白酶解物的制备取一定量的核桃蛋白用水溶解(质量分数3%),用0.5mol/LNaOH调节反应体系pH=8.0,于50℃恒温振荡反应。将50℃预热的碱性蛋白酶(Alcalase2.4L)加人到反应体系中,启动酶解反应;反应过程中加入NaOH以维持反应体系的pH值。反应3h后,于90℃水浴保持10rain,使酶失活;以3500r/min转速离心30rain,上清液即为核桃蛋白酶解物。
1.2.3核桃蛋白酶解物的分离纯化将核桃蛋白酶解物用截留分子量(MWCO)为3000的超滤管进行超滤,超滤组分进行抗氧化实验.对核桃蛋白酶解物超滤后抗氧化强的组分进一步用SephadexG-25凝胶层析柱分离纯化,收集各组分、冻干,进行抗氧化实验筛选.取SephadexG-25纯化后抗氧化活性最强的组分进一步用HPLC纯化,收集各组分、冻干,进行抗氧化实验筛选.
1.3核桃蛋白酶解物的抗氧化活性研究
1.3.1DPPH清除能力(DRSA)实验参照文献方法测定酶解物的DPPH清除能力,DPPH清除能力按下式计算:
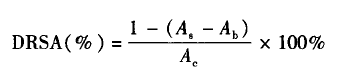
式中,As为蛋白酶解物的吸光度;Ab为样品背景的吸光度(不加DPPH);Ac为对照管的吸光度(水代替样品).
1.3.2羟基自由基(·OH)清除能力(HRSA)实验参照文献方法测定酶解物的羟基自由基清除能力,羟自由基清除能力按下式计算:
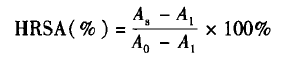
式中,A8为蛋白酶解物的吸光度;A1为损伤管的吸光度(水代替样品);A0为未损伤管的吸光度(水代替双氧水).
1.3.3还原力的测定参照文献方法,以酶解物还原三价铁为二价铁,用铁氰化钾检测二价铁,溶液在500nin处有吸收,吸光度值与还原力成正比.
1.4核桃蛋白酶解多肽的序列鉴定
将HPLC纯化后抗氧化活性最强的组分先用UPLC测定其纯度,再用LC.ESI-Q.TOF手段鉴定肽段的一级序列.
UPLC条件:流动相A为超纯水[含0.1%甲酸(体积分数)],流动相B为乙腈;梯度洗脱:5%-50%B(0~14min);柱温30oC;流速0.3mL/min;进样量10ul测序色谱条件:流动相A为超纯水[含0.1%甲酸(体积分数)],流动相B为乙腈;梯度洗脱:5%~70%B(O一20min),70%B(20—25rain);柱温30℃;流速0.3mL/min;进样量10斗ul。
测序质谱条件:电喷雾正离子电离模式,质量扫描范围m/z50~2000,气体温度350oC,干燥气流速9L/min,喷雾气压0.28MPa,毛细管电压3.5kV,裂解电压150V,锥孔电压65V.利用PeaksViewer4.5软件(BioinformaticsSolutionsInc.)和手动计算相结合的方式鉴定多肽序列.
2结果与讨论
2.1核桃蛋白酶解物的分离与纯化
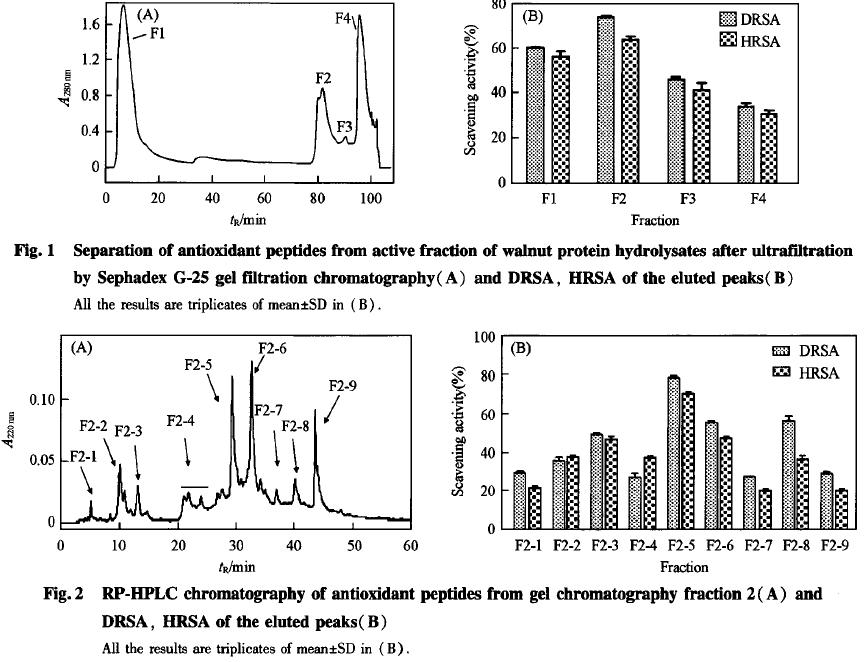
利用超滤管超滤核桃蛋白酶解物后,用DPPH清除实验及羟基自由基清除实验来检测酶解物分子量分别大于和小于3000的组分的抗氧化活性.结果表明,酶解物分子量小于3000的组分具有更强的抗氧化能力,故取此组分进行下一步分离纯化.经SephadexG-25分离纯化共获得4个主要洗脱峰F1,F2,F3和F4[图1(A)];经抗氧化实验[图1(B)]发现F2具有更强的抗氧化活性.收集砣组分,冻干后进一步利用HPL纯化[图2(A)],发现F2-5抗氧化活性最强,多次收集,冻干2.2核桃蛋白酶解物的抗氧化活性DPPH自由基清除能力测定是一种常见的筛选和评价抗氧化剂活性的有效方法.DPPH是一种较为稳定的自由基,分子结构中有未成对电子,其乙醇溶液呈蓝紫色,在517nm处有最大吸收值.当未成对电子被其它自由基电子配对后,吸收值降低,其褪色程度与所接受的电子数呈定量关系.当与抗自由基活性物质反应时,溶液颜色变浅,吸收值降低.吸收值越低表明该物质的抗自由基活性越强.羟基自由基清除力的测定选用邻二氮菲法,以H:0:/Fe2+体系通过Fenton反应产生羟自由基,总反应可表示如下:
Fe2++H202—_Fe3++OH一+·OH邻二氮菲一Fe2+水溶液被羟自由基氧化为邻二氮菲一Fe3+后,其515nm吸收峰明显降低,根据以上原理,变化反映羟自由基的氧化作用.
图1(B)和图2(B)分别为核桃蛋白酶解物经过SephadexG-25纯化后的4个组分(F1,砣,F3和F4)和组分F2经过HPLC分离纯化后各组分的DP—PH和羟基自由基清除力测定结果.图1(‘B)显示,4个组分均具较好的DPPH和羟基自由基清除力,其中F2的抗氧化能力最强.图2(B)显示,F2-5的DPPH和羟基自由基清除力最强,收集多次冻干,分别用于测定还原力实验和多肽序列.
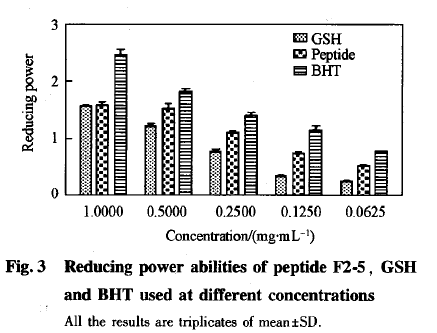
图3为组分F2-5.、阳性对照还原型谷胱甘肽(GSH)及二丁基羟基甲苯(BHT)的还原力实验结果。样品的抗氧化能力与还原力密切相关,19J还原力越强则吸光度值越大。随着F2-5、谷胱甘肽和二丁羟基甲苯浓度的增大,还原力逐渐增强;当F2-5浓度为1mg/mL时还原力达到1.5,与谷胱甘肽相当,说明F2—5具有较好的还原力.
2.3核桃蛋白酶解多肽的序列鉴定
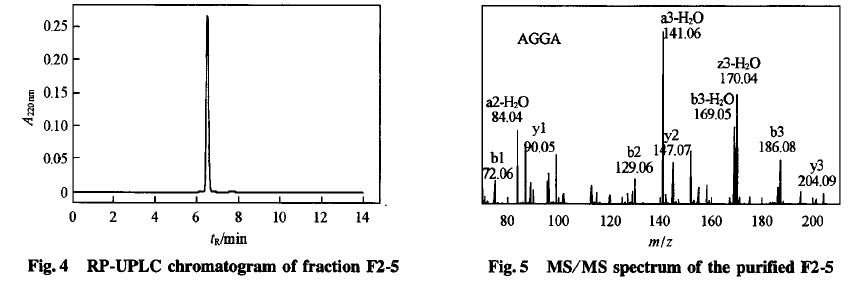
将F2-5冻干样品用水溶解,先用液相色谱测定其纯度,结果显示谱图中(图4)只有1个峰,可见其为纯品;再利用液相色谱一质谱进行序列鉴定.MS/MS图谱利用专业软件Peaks的denovo功能进行分析,所得结果再手动计算确认,结果如图5所示.F2-5的氨基酸序列为A1a-Gly—Gly—A1a.Chen等M’2叫和Sampath等指出,活性肽中疏水性氨基酸有利于增加脂溶性,抑制油脂的氧化;甘氨酸的侧链只有1个氢原子,多肽骨架具有较高的灵活度,有利于增加多肽的抗氧化能力旧,故本文中的活性肽也具有一定的抗氧化活性.
3结论
核桃蛋白质通过碱性蛋白酶水解后得到的酶解物具有较强的抗氧化活性;经过多步分离纯化后得到多肽Ala—Gly—Gly—Ala,其还原力和谷胱甘肽相当.本文为进一步研究核桃多肽的抗氧化机理及核桃的深加工提供了一定的理论和实验依据,为核桃作为抗氧化的保健品及药品食品添加剂的开发提供了思路。


 公告信息:
公告信息:


















