酶解蛋白带来功能特性改善或释放出具某种生理功能生物活性肽都与蛋白质水解程度具有很大关联,即与水解度(DH)有关。目前测定蛋白质水解度方法有很多。但都依据以下原理哺~刀:通过滴定水解过程释放质子数或利用游离氨基反应测定。常见方法有:TNBS(三硝基苯磺酸)法、OPA(邻苯二甲醛)法、甲醛固定法、茚三酮比色法、TCA(三氯乙酸)法和pH-Stat等嚏。上述每种方法都有其各自优缺点和适用范围,目前很少有比较它们准确性研究报道,因此本实验根据WPI酶解条件和实验室常用试剂和设备,选择较为方便可行甲醛固定法、TNBS法和pH—Stat法进行比较,旨在评价哪种方法更适于WPI水解液水解度测定研究。
1材料与方法
1.1实验材料与试剂
Alcalase2.4L碱性内切蛋白酶(2.4AU/g):丹麦Novo公司;Protamex复合蛋白酶(1.5AU/g):丹麦Novo公司:WPI(蛋白质量分数80.1%)、TNBS(三硝基苯磺酸):Sigma公司;L一亮氨酸标准品:沃尔森(西安)公司:甲醛溶液(37%,-一40%);其它试剂均为分析纯级。
1.2主要仪器及设备
BS323S-电子天平:赛多利斯科学仪器(北京)有限公司;501A型超级恒温器:上海实验仪器厂有限公司;PB-10型精密酸度计:赛多利斯科学仪器(北京)有限公司;JBZ-14H型磁力搅拌器:上海大浦仪器有限公司;KDN--04C型数显消化炉:上海洪纪仪器设备有限公司;KDN-04C型凯氏定氮仪:上海洪纪仪器设备有限公司;UV-2600系列紫外分光光度计:尤尼柯(上海)仪器有限公司。
1.3核桃蛋白酶解
WPI酶解工艺流程如下:
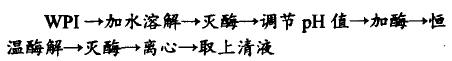
称取一定量WPI,加无C02水配制成3%(w/v,以蛋白质计)底物浓度,90℃灭酶10min,冷却至室温后,调节至最适pH值,加入5%(w/v)酶,充分混匀,置于超级恒温器中,调节温度至55℃开始反应,酶解5h,间隔一定时间,定量移取,通过煮沸2min灭酶终止反应,10000rpm离心20re_in,取上清液测定水解度。
1.4TNBS法测定水解度
参考Adler-Nissenn0~123方法略作修改,酶解液0.125ml,加入含有lm1磷酸盐缓冲液(0.2125mol/LNaH2P04加入0.2125mol/LNa2HP04中直至pH值为8.2±0.02)小管中,再加入1ml0.1%(w/v)TNBS,在避光条件下,放入50℃恒温水浴锅中,振荡反应60min后取出,室温冷却20min,再加入2ml0.1mol/LHCI终止反应,稍微振荡一下,在340nm波长处测定吸光度。标准曲线绘制采用L一亮氨酸作标准品,在0---,40mmol/L范围内绘制。DH计算公式如(1)所示:
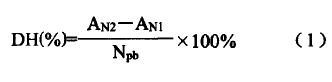
式中:Am为蛋白水解前氨基氮含量,(rnmoL/g蛋白);AN2为蛋白水解后氨基氮含量(mmoL/g蛋白);N口b为蛋白底物中肽键氮含量(mmoL/g蛋白),即蛋白氮。
1.5pH—Stat法测定水解度
pH—Stat法主要是基于蛋白质水解过程中,总伴随质子释放或吸收n3~1钔,质子化多少,依赖于溶液pH,通过加入用于维持体系pH的碱或酸量,直接计算水解度。DH计算公式如(2)所示:
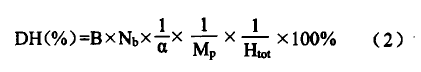
式中:B为NaOH标准溶液体积,(m1):Nb为NaOH标准溶液浓度,(mol/L);Q为氨基离解度;M。为底物中蛋白质总含量,(g);Htot为底物蛋白质肽键总数,(mmol/g),本文核桃蛋白Htot值是8.0mmol/g。
1.6甲醛滴定法测定水解度
取水解灭酶后8.0ml酶解液,置于200ml烧杯中,加入60IIll无C02水,开动磁力搅拌器,加少量碱液调节pH为8.20,再加入10Ⅱll中性甲醛溶液,用0.5mol/LNaOH标准溶液调节体系pH值至9.20,记录消耗NaOH标准溶液体积为V(m1)。
同时取未酶解相同浓度蛋白质溶液8.0ml,按上述方法作空白试验,记录消耗NaOH标准溶液体积为vo(m1)。DH计算公式如(3)所示:
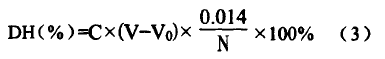
式中:C为NaOH标准溶液浓度,(mol/L);V为酶解液消耗NaOH标准溶液体积,(m1);V0为空白液消耗NaOH标准溶液体积,(m1);0.014为氮毫克当量;N为底物样品总氮含量,(g)。
2结果与讨论
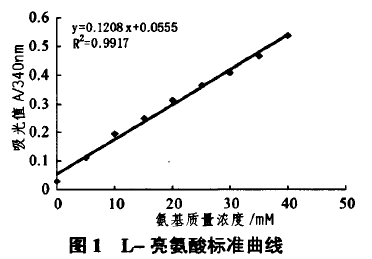
2.1L-亮氨酸标准曲线
按1.4方法选用L_亮氨酸作标准品,TNBS显色后测定吸光度,绘制标准曲线,见图1。由图l可看出,游离氨基质量浓度与吸光度呈线性关系,线性方程为:r--o.1208x+0.0555,R2=o.9917,换算成Jd心关系为C=8.278A-o.459(mmol/L)
2.2三种方法测定结果
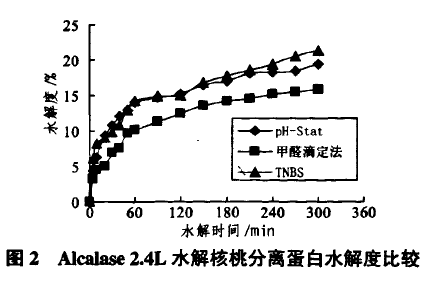
2.2.1Alcalase2.4L酶解WPI测定结果
本实验在一定酶解条件下,即3%核桃蛋白溶液(w/v)、加入5%(w/v)Alcalase2.4L、调节pH值为8.0、温度为55℃,间隔不同酶解时间后,移取酶解液分别进行水解度测定。测定水解度时甲醛滴定法和TNBS法都是基于对游离氨基酸进行定量,预期两种方法测定水解度比较接近,但数据显示并不接近。由图2可看出,在采用Alcalase2.4L酶解核桃分离蛋白时,pH—Stat法和TNBS法测定值接近,方差分析结果表明,TNBS法仅比pH—Stat法平均低0.4%。而甲醛滴定法比两者稍低,这是因脯氨酸与甲醛作用后,生成不稳定化合物,导致滴定结果偏低。
因此采用甲醛滴定法测定富含脯氨酸原料,其结果偏低;采用甲醛滴定法测定微弱水解物水解度时,误差较大。核桃蛋白质含有一定量脯氨酸(4.29%)n卯,脯氨酸与甲醛反应生成不稳定化合物,导致测定结果偏低;而TNBS法并未有此现象,这就解释TNBS法测定结果与pH—Stat法基本一致,而甲醛滴定法偏低结果。
2.2.2Protamex酶解WPI测定结果
核桃分离蛋白酶解因目标物是短肽,所以应尽量避免使用外切蛋白酶。根据文献相关报道,本实验除采用水解度较高Alcalase2.4L(内切蛋白酶)外,还根据目标物生理活性,选用Protamex(内切和外切肽酶复合体)进行酶解。加入5%Protamex、调节pH值为7.0、温度为50℃,经不同酶解时间后,取酶解液分别进行水解度测定。
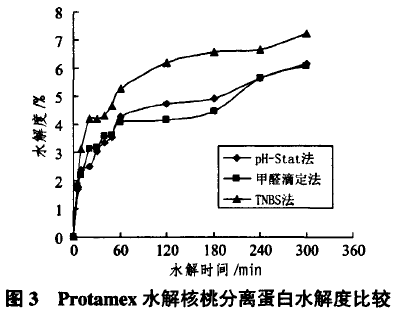
由图3可知,与Alcalase2.4L酶解不同的是,用Protamex酶解时,甲醛滴定法与pH-Stat法接近,均低于TNBS法;方差分析结果表明,TNBS法测定结果与另两法差异显著(P<0.05)。甲醛滴定法偏低原因在2.2.1已予解释;而pH-Stat法测定值偏低是由于其水解度计算与l/a有关,而Ct与温度、pH值及氨基解离度(pK)有关,计算公式如(4)式:
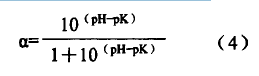
在Protamex酶解条件下,若温度和pH值都不变,a仅取决于pK值,由于游离氨基酸、二肽和三肽氨基基团pK值比多肽稍高¨们,采用Protamex水解时,由于含部分外切酶,所以酶解产物含有较多游离氨基酸和二肽、三肽,故在用pH-Stat法测定水解度时I/a偏低就导致计算水解度降低。在用Alcalase2.4L进行酶解时,由于是内切肽酶,游离氨基酸和二肽、三肽很可能会相对降低,这意味在水解过程中I/0【值变化可忽略不计,pH-Stat法测得值应较精确,
3结论
pH—Stat法被证实是一种简单、快速测定WPI水解液水解度方法,可重复性高,通常被用于水解度连续测定。然而该法在研究中需用其它方法加以校正,且所测得水解度值精确度依赖于所使用酶种类;当使用富含外切蛋白酶时,pH—Stat法所测水解度值低于预期值。甲醛滴定法也是一种较为常用测定WPI水解度方法;但因WPI富含脯氨酸,与甲醛生成不稳定产物,使测定值偏低,所以测定核桃分离蛋白时,甲醛滴定法精确度较低。TNBS法被证实也是一种较好测定WPI水解度方法,非常灵敏,且不受酶特异性影响;但由于需要较长反应时间和冷却步骤,所以,不能实时反应水解过程水解度。
但值得一提的是,酶解WPI获取多肽主要目标物是短肽,使用的酶大多为内切蛋白酶:所以,采用pH—Stat法测定WPI水解液水解度时所得值应较为准确


 公告信息:
公告信息:


















