DHA,即二十二碳六烯酸,俗称脑黄金,是一种对人体非常重要的多不饱和脂肪酸,属于w-3不饱和脂肪酸家族中的重要成员。DHA是神经系统细胞生长及维持的一种主要物质,是大脑和视网膜的重要构成成分,在人体大脑皮层中含量高达20%,在眼睛视网膜中所占比例最大,约占50%。它对人的视觉形成、大脑活动、心脑血管疾病、免疫功能及老年性痴呆症均有极大影响。在儿童期DHA有助于脑神经细胞间突触联系的增加,在老年期DHA则有助于延缓大脑萎缩、改善记忆力减退。当DHA缺乏时,可引发生长发育迟缓、不育、皮肤异常鳞屑、智力障碍、免疫力低下甚至癌变等一系列症状。
随着我国油脂产业的迅速发展,市场上出现了一些新型调和油,DHA食用调和油产品在市场上迅速推广并且在消费者中得到广泛认可,与产品得到迅速发展形成鲜明对比的是,相关DHA食用调和油产品的DHA含量检测方法却处于停滞状态。因此,开展对DHA食用调和油中DHA含量检测方法的研究,可进一步规范和服务DHA食用调和油的发展。
目前国内外测定油中DHA的常用色谱方法分为内标法和外标法。国标方法如GB/T5009.168-2003(食品中二十碳五烯酸和二十二碳六烯酸的测定)、GB/T17377-2008(动植物油脂脂肪酸甲酯的气相色谱分析)、GB/T5413.27—2010(婴幼儿配方食品和乳粉DHA、EPA的测定)等均采用外标法。国际上测定DHA的方法如AOCS Official Meth—od Ce 1b-89(用气液色谱法测定海洋鱼油中脂肪酸组成)、AOAC Official Method 991.39(气相色谱法微胶囊鱼油和甲酯、乙酯鱼油中脂肪酸的测定)、AOAC Official Method 996.06(食品中脂肪酸的测定)等均采用内标法来测定DHA或其他脂肪酸含量。
本文采用气相色谱法测定海藻油和DHA调和油中DHA的含量,并将GB/T5009.168、AOCS Official Method Ce 1b-89和GB/T173773种方法测定结果进行对比,以期找出最合适的DHA含量测定方法。
1材料与方法
1.1实验材料
DHA标准品(纯度≥99%)、C23:0甲酯标准品(纯度≥99%):购自成都博奥生物科技公司;海藻油(DHA含量37.0%):Martek Biosciences Corpora—tion Columbia,USA;DHA调和油:自制;正己烷、甲醇、氢氧化钠、氯化钠、异辛烷、无水硫酸钠、盐酸,均为分析纯。
1.2实验设备
岛津GC一2010 Plus气相色谱仪,R-201旋转蒸发仪,SHB—B95型循环水式多用真空泵,Sartori-us BS 224S分析天平。
1.3实验方法
以海藻油为原料调配DHA调和油,首先根据海藻油中DHA的含量,调配出DHA含量为200mg/kg的食用调和油,以此进行DHA检测方法的研究。
1.4测定方法
1.4.1GB/T 5009.168测定海藻油及DHA调和油中的DHA含量
1.4.1.1前处理
称取1g油样于50mL具塞容量瓶中,加人10mL正己烷轻摇使油样溶解。吸取此溶液1~5mL于具塞比色管中,加入2mol/L氢氧化钾甲醇溶液1mL,充分振荡10min后放人60℃水浴加热1~2min,冷却到室温,待甲酯化用。加入2mol/L盐酸甲醇溶液2mL,充分振荡10min,并于50℃加热2min,弃去下层液体,再加约2mL蒸馏水洗净并去除水层,用滴管吸出正己烷层,移至另一装有无水硫酸钠的漏斗中脱水,脱水后的溶液在70℃水浴上加热浓缩,定容至1mL,待上机分析。
1.4.1.2色谱条件
PEG-20M毛细管脂肪酸分析柱(30m×0.53mmx1um),氢离子火焰检测器(FID)温度220摄氏度,进样口温度210℃,柱温185摄氏度,载气(He)流速6.0mL/min,氢气流速40mL/min,空气流速400mL/min。
1.4.2GB/T17377测定海藻油及DHA调和油中的DHA含量
1.4.2.1前处理
称取350mg油样加人50mL烧瓶中,移取6mL0.5mol/L氢氧化钠甲醇溶液于油样中,并加入几粒沸石,连接回流装置,开始加热回流,回流过程中不断摇动烧瓶;当烧瓶内油珠消失,溶液变得透明时,从冷凝器上端加7mL15%三氟化硼甲醇溶液于烧瓶内,继续回流1min;然后从冷凝管上端加入4mL异辛烷,再回流1min;撤离热源,取出烧瓶,向烧瓶中加入5mL饱和氯化钠溶液,轻轻上下颠倒数次后,静置分层;将异辛烷提取物集中在一起,并加入适量的无水硫酸钠以去除痕量的水分,浓缩至1mL,待上机分析。
1.4.2.2色谱条件
聚酯毛细管色谱柱(30 m × 0.53 mm x 1 um),氢离子火焰检测器(FID)温度230摄氏度,进样口温度210℃,柱温180℃,载气(He)流速5.0mL/min,氢气流速70mL/min,空气流速400ml/min。
1.4.3 AOCS Official Method Ce lb-89测定海藻油及DHA调和油中的DHA含量
1.4.3.1前处理
精确称取约25mg的C23:0甲酯内标物于25mL容量瓶,然后用异辛烷定容,吸取1mL的内标液加入试管中并把溶剂蒸发,将试管冷冻保藏(不立即使用时);精确称取25mg油样加入含有内标物的试管,添加1.5mL0.5mol/L氢氧化钠甲醇溶液,盖紧盖子,振摇并加热到100℃保持5min;冷却,添加2mL15%三氟化硼甲醇溶液,充氮保护,盖紧盖子,振摇并加热到100℃保持30min;冷却到30~40,添加1mL异辛烷,充氮保护,加盖,振摇或者激烈摇晃30S;立即加人5mL饱和氯化钠溶液,充氮,加盖并激烈振摇;冷却到室温,当异辛烷层和水层分离后,将异辛烷层转移到干净的试管中,充氮,加盖;再用1mL异辛烷提取水相;将异辛烷提取液集中在一起,浓缩至1mL,待上机分析。
1.4.3.2色谱条件
Supercowax-10毛细管脂肪酸分析柱(30 m x 0.32 mm x 0.25 m);氢离子火焰检测器(FID)温度270℃;进样口温度250摄氏度,柱箱起始温度170摄氏度,保持0min,程序升温至225℃,保持0min,升温速率1.0摄氏度/min;载气(He)流速6.0mL/min,氢气流速40mL/min,空气流速400ml/min。
2结果与讨论
2.1 3种方法测定海藻油中的DHA
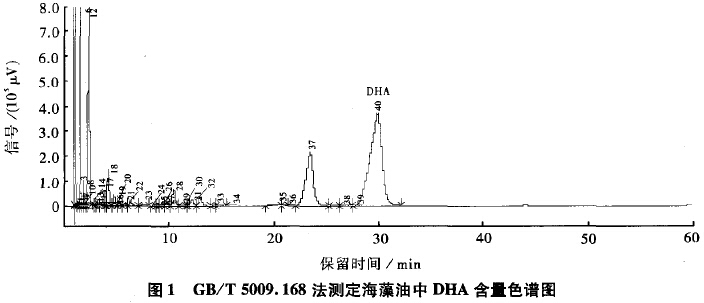
对海藻油进行脂肪酸检测,由于海藻油中DHA含量较高,3种方法都能比较准确地检测DHA的含量,经检测海藻油中DHA含量为36.6%~37.1%(见表1),与Martek提供的数据一致。图1为采用GB/T5009.168方法检测海藻油中DHA含量的色谱图。
2.23种方法测定调和油中的DHA
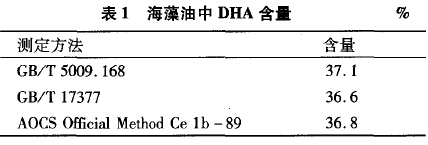
图2为GB/T5009.168方法检测的色谱图。图2可见,可以检测到DHA峰,DHA调和油中DHA由出峰时间为29.212min,峰分离情况良好。
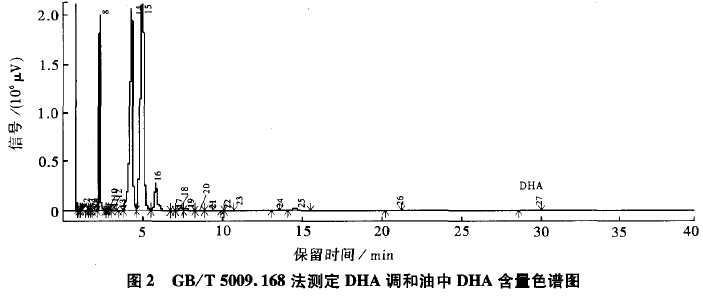
图3为GB/T17377方法检测的色谱图。由图3可见,图中没有检测到DHA峰。实验发现,反复进样,仍然检测不到DHA,说明该方法不适用于DHA含量较低样品的检测。
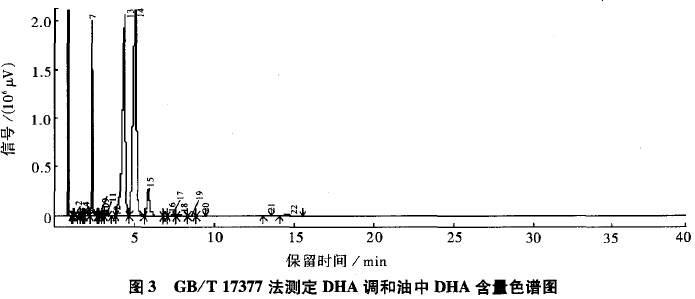
图4为AOCS Official Method Ce lb-89法测定DHA调和油中DHA含量的色谱图。由图4可知,DHA调和油中DHA的出峰时间为29.531min。实验发现,测定稳定性较差,该法采用内标法,操作程序较为麻烦,寻找合适的内标物也很困难。因此,该方法不用于DHA含量低的DHA食用调和油的检测。
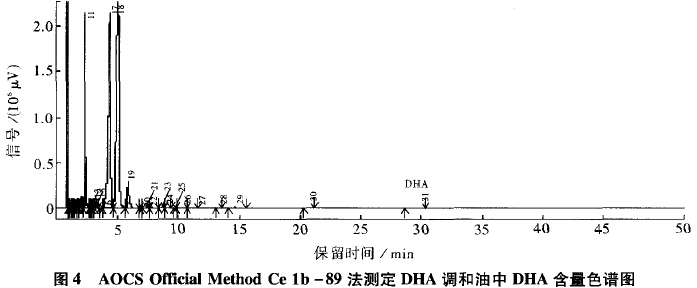
综上所述,对于DHA含量较高的海藻油,3种方法都能比较准确地检测DHA含量,而对于DHA含量较低的DHA食用调和油,GB/T17377方法未能有效检测到DHA,而AOCS Official Method Ce 1b-89法稳定性较差,并采用内标法,操作程序较为麻烦,寻找合适的内标物也很困难。因此,选择GB/T5009.168方法作为DHA食用调和油中DHA含量的检测方法,该法峰分离情况良好,采用外标法,操作简便、易行、安全。
2.3DHA标准曲线的建立
根据GB/T5009.168方法,采用DHA作为标准品进行分析检测,以DHA质量浓度为横坐标,相应的峰面积为纵坐标,得到标准曲线,见图5。
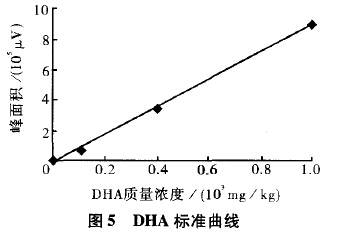
DHA标准曲线方程为:Y=926 263X-23140,R2=0.9998该标准曲线在DHA含量为(0~1.0)×10mg/kg范围内线性良好。
2.4测定DHA调和油中DHA的含量
根据GB/T5009.168方法,参照标准曲线,测定调和油中的DHA含量。结果表明,调和油中DHA含量测定结果在190-210mg/kg之间,在误差范围之内,并经反复验证,对于不同范围低含量的DHA食用调和油,可准确检测其DHA含量,检测结果准确可靠。
3结论
对GB/T5009.168、GB/T17377、AOCS Official Method Ce lb-89测定方法比较可以看出,对于DHA含量较高的海藻油,3种方法均能准确检测出其中的DHA含量;而对于DHA含量较低的DHA食用调和油,GB/T5009.168方法则准确可靠,重复性好,并且采用外标测定法,相对比较简单易操作,能较好地满足DHA食用调和油中低含量的DHA检测需求


 公告信息:
公告信息:


















